融教之家是国内领先的融合教育和特殊教育资讯平台,关注融合教育行业动态和政策,坚持为从业者提供高质量内容和多项学习服务,促进融合教育传播和发展。
2021年,来自27个国家和六大洲的80名ADHD领域的著名研究者发表一篇名为《世界ADHD联盟国际共识声明:关于ADHD的208个基于证据的结论》、关于ADHD共识声明的学术文章在《神经科学与生物行为综述》学术期刊上。在该声明中提到,ADHD很少是由单一的遗传或环境风险因素引起的,大多数情况下ADHD是由许多遗传和环境风险的综合影响引起的,且每一个遗传和环境风险的影响很小。

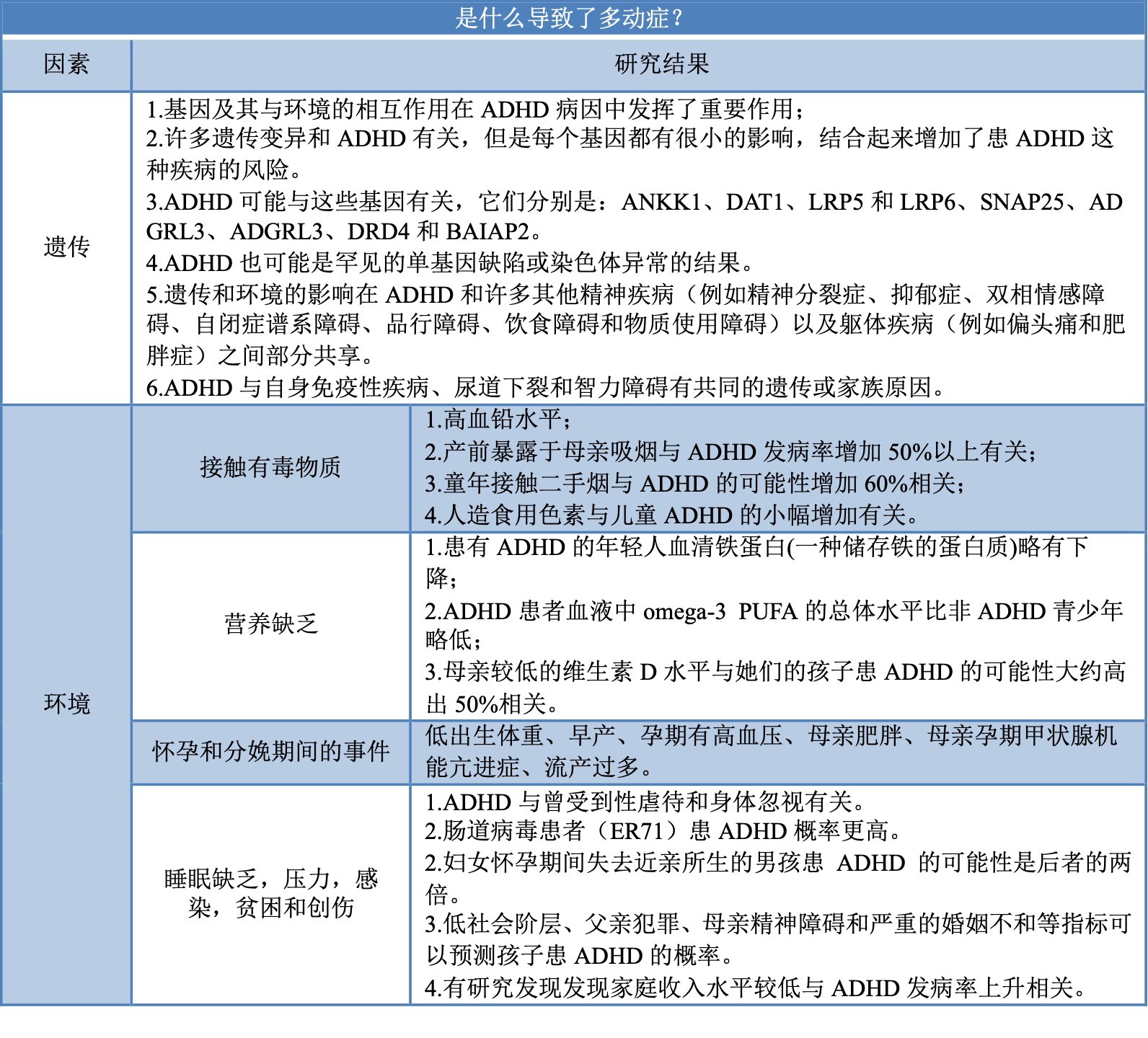
1. 遗传因素
一项对美国,欧洲,斯堪的纳维亚和澳大利亚的37项双胞胎的研究发现,基因及其与环境的相互作用在导致ADHD上发挥着重要作用(Faraone和Larsson,2018年;Larsson等人,2014a;Pettersson等人,2019年)。
在一项全基因组研究中,一个国际团队对来自美国、欧洲、斯堪的纳维亚、中国和澳大利亚的2万多例ADHD患者和35,000例健康对照的DNA样本进行了分析。他们确定了许多遗传位点的变异,每个位点变异对ADHD的发生有一个很小的效应(Demontis等人,2019)。这项研究证实了大多数ADHD患者是多基因位点变异,这意味着许多遗传变异(每种效应非常小)结合起来以后,增加了患ADHD的风险。ADHD的多基因变异因素与一般的精神病理学(Brikell等人,2020)和很多精神病性疾病(Lee PH,2019)有关。
meta分析暗示了其他基因的存在,但是它们是否是致病基因仍不确定,直到在全基因组研究中得到证实。这些基因是ANKK1(Panet等人,2015)、DAT1(Grunblattet等人,2019b)、LRP5和LRP6(Grunblattet等人,2019a)、SNAP25(Liuet等人,2017)、ADGRL3(Bruxelet等人,2020)、DRD4和BAIAP2(Bonvicini等人,2020;Bonvicini等人,2016)。
ADHD的多基因遗传因素能够预测人群的ADHD症状,这表明ADHD作为一种疾病的遗传原因也会影响人群中ADHD症状的亚阈值水平(Demontis等人,2019年;Taylor等人,2019年)。
ADHD多基因变异的人更有可能被诊断出患有ADHD(Li,2019)、焦虑或抑郁(Martin等人,2018)。
ADHD也可能是罕见的单基因缺陷(Faraone和Larsson,2018)或染色体异常(Cederlof等人,2014)的结果。根据对8,000多个自闭症(ASD)和/或ADHD儿童以及5,000个对照的DNA的分析显示,与对照相比,患有自闭症和ADHD的儿童的罕见基因突变发生率更高(Satterstrom等人,2019)。
根据对家庭、双胞胎和DNA的研究表明,ADHD与许多其他精神疾病(例如精神分裂症,抑郁症,躁郁症,自闭症,行为障碍,饮食障碍和药物使用障碍)和身体疾病(例如偏头痛和肥胖)之间的遗传和环境的影响有部分交叉。(Demontis等人,2019)(Faraone和Larsson,2018)(Ghirardi等人,2018)(Lee 等人,2019)(Lee等人,2013)(Anttila等人,2018;Tylee等人,2018)(van Hulzen等人,2017)(Vink和Schellekens,2018)(Brikell等人,2018)(Chen等人,2019a)(Yao等人,2019)。然而,ADHD也有独特的遗传风险。疾病之间存在共同的遗传和环境风险的证据表明,这些疾病在生物学途径中也具有病理学特征,从而异常调节神经发育并造成导致疾病发作的大脑损伤。
大量的针对家庭的研究表明,遗传或家族原因可能导致ADHD与自身免疫性疾病(Li等人,2019),尿道破裂(Butwicka等人,2015)和智障(Faraone和Larsson,2018)相关。

2. 环境因素
(1)接触有毒物质
一对meta分析发现重金属铅与注意力不集中症状(27项研究,超过9,300名年轻人)和ADHD(23项研究,超过7,800名年轻人)之间的相关性很小(Goodlad等人,2013)。最近一项对14项研究进行的meta分析对17,000多名儿童进行了研究,结果表明血铅水平升高可能导致他们患有ADHD的几率翻番(Nilsen和Tulve,2020)。根据美国国家卫生和营养检查调查(National Health and Nutrition Examination Survey)进行的具有全国代表性的样本的2500多名青年进行的一项研究发现血液中铅水平排名前三分之一的人患ADHD的可能性是其他人的2.3倍(Froehlich等人,2009)。一项类似的研究(来自同一国家的调查中有4,700多名年轻人)发现,血液中铅水平最高的前五分之一的人患ADHD的几率是后五分之一的人的四倍(Braun等人,2006)。
对超过三百万人的二十项研究进行的三项meta分析发现孕妇产前暴露于吸烟环境产出的婴儿ADHD的发病率增加了50%以上(Huang等人,2017)(Dong等人,2018);Nilsen和Tulve,2020年)。尽管这种关联在大的人群研究中也已被看到(Joelsson等人,2016;Obel等人,2016;Skoglund等人,2014),但在调整了ADHD的家族史后消失了,这表明怀孕的母亲暴露于吸烟环境是由于家族或基因增加了孩子患有ADHD的风险。
对横跨三大洲和十万多人参与的九项研究进行的meta分析发现,儿童时期接触二手烟会导致患有ADHD的可能性增加60%。目前尚不清楚关联在多大程度上是因果关系,而主要是归因于混杂的因素(Huang等人,2020)。
在一项针对15位双盲的、安慰剂对照试验(共219位参与者)的meta分析中,人造食用色素可能导致儿童患有ADHD的可能性小幅增加(Schab和Trinh,2004)。另一项794人参与的20项研究的meta分析发现ADHD症状的增加很小,但这只有在父母评定,而老师或其他观察者不参与评定的情况下,ADHD症状才会增加(Nigg等人,2012)。
在台湾,一项针对10,000名婴儿的研究发现,母亲在怀孕期间使用对乙酰氨基酚会使孩子患ADHD的可能性增加33%(Chen等人,2019b)。而在挪威的另一项研究检查了挪威母婴群组和挪威患者登记处的113,000个后代,其中包括2,246名患有ADHD的后代,发现孕妇产前使用乙酰氨基酚的量与ADHD的之间存在正相关关系(Ystrom等人,2017)。
根据一项丹麦国家登记处的对1997年至2011年之间出生的913,000名儿童进行的全国性研究指出,产前暴露于抗癫痫药丙戊酸盐会使患有ADHD的风险增加50%。没有发现ADHD与其他抗癫痫药的相关性(Christensen等人,2019)。
根据挪威登记处的一项研究,从超过24,000人中随机抽取了297名患有ADHD的儿童和553名正常儿童。在控制了其他变量(例如分娩时的产妇年龄,孩子的性别,产妇的学历,婚姻状况和孕妇吸烟等)后,发现邻苯二甲酸酯代谢物水平最高的五分之一的母亲的孩子患ADHD的几率是最低五分的五分之一的三倍。(Engel等人,2018)。
有机磷酸酯农药可以用作有效的神经毒素。在来自美国的1,139名的儿童样本中,有机磷酸酯代谢产物二甲基烷基磷酸二甲酯(DMAP)增长了十倍,他们患ADHD的几率增加了55%。拥有DMAP可检测水平最高的代谢产物的儿童患ADHD的可能性是DMAP不可检测水平的儿童的两倍(Bouchard等人,2010)。
一项meta分析发现,两类空气污染物——颗粒物(六个研究,超过51,000人参与)和氮氧化物(五个研究,超过51,000人)对ADHD的发生率没有显著影响(Zhang等人,2020b)。一项在全台湾进行的,对超过16,000对母婴参与研究发现,在孕妇妊娠期接触的空气中的小颗粒物水平,二氧化硫水平或二氧化氮水平与孩子前八年的ADHD诊断之间没有显著关联。它确实发现当孕妇暴露于一种常见的交通污染物一氧化氮中时,儿童患有ADHD的可能性增加了25%(Shih等人,2020)。
一项利用韩国国家健康保险登记中心的全国性研究确定了2013年至2015年所有7200名主要诊断为ADHD的青少年患者,并每天从全国318个监测站读取三种空气污染物的读数。研究发现,二氧化氮,二氧化硫和颗粒物出现峰值后,随后几天与ADHD患者的住院人数分别增加了47%,27%和12%。男性和女性青少年之间,或老年和年轻青少年之间患有ADHD的概率没有显着差异(Park等人,2020)。
在欧洲,4,826名母婴参与的九项研究的meta分析发现了婴儿期通过母乳接触全氟烷基物质(PFAS)与ADHD的没有关联(Forns等人,2020)。
对来自三大洲六个国家的总计25,000多名参与者的七项研究进行的meta分析没有发现青少年糖摄入与ADHD之间有关联(Farsad-Naeimi等人,2020)。

(2)营养缺乏
一对meta分析发现,患有ADHD的年轻人血清中铁含量与常人没有差异(六项研究,617人参与),但是血清铁蛋白(一种储存铁的蛋白质)的降低程度从中到低(十项研究,超过2,100人参与)(Wang等人,2017)。另一对meta分析得出了同样的结论(六项研究,超过1,700名参与者),但血清铁蛋白的降低程度从小至中等程度(十二项研究,超过6,000人参与)(Tseng等人,2018)。
一项对586人参与的9项研究的meta分析发现,患有ADHD的人群血液中的总omega-3 PUFA水平比非ADHD青年人的血液低一些(Hawkey和Nigg,2014)。
在芬兰,一项使用国家登记处的对全国人群病例对照研究比较了1998年至1999年之间出生的1,067名ADHD患者和1,067名正常人的对照组。母亲体内维生素D水平较低可能让孩子患有ADHD的可能性增加约50%(Sucksdorff等人,2019)。

(3)怀孕和分娩期间的事件
一项对超过6,000人参与的12项研究的meta分析发现,很/极早产或很/极低出生体重婴儿的ADHD发病率增加了三倍(Franz等人,2018)。另一项总计460万以上人参与的85项研的meta分析,发现低出生体重与ADHD之间存在从低到中等的相关性(Momany等人,2018)。在瑞典,一项针对120万儿童的研究发现,随着过早成熟的增加,儿童患有ADHD的可能性逐步增加。结果并非归因于ADHD的社会经济压力(Lindstrom等人,2011)。芬兰国家登记局将10,000多名ADHD患者与38,000多名对照者进行了比较(Sucksdorff等人,2015),发现了类似结果。
对140万人参与的六项研究的meta分析发现,母亲在怀孕期间患有高血压的儿童的ADHD患病率增加了25%(Maher等人,2018)。
在瑞典,一项针对超过200万儿童,其中115,000名患有ADHD的儿童的研究发现,孕期母亲有子痫前症可能导致他们的孩子患有ADHD的可能性增加15%,在胎龄暴露于先兆子痫的患有ADHD的可能性上升到40%。家庭中的这种模式表明,这并非由于基因或其他家庭因素的影响(Maher等人,2020)。
两项meta分析,一项包含七项研究,涉及28,000多名参与者,另一项包含三项研究,涉及140万名参与者,发现肥胖的母亲的孩子患ADHD的可能性增加约60%(Jenabi等人,2019;Sanchez等人,2018)。对参与丹麦国家出生群组的80,000多对母子的研究表明,肥胖的母亲的孩子患ADHD的风险增加了近50%,严重肥胖母亲的孩子患该病的风险增加了一倍(Andersen等人,2018)。
一项对两项大型群组研究的meta分析总计超过310万人,发现孕期孕妇患有甲状腺功能亢进症与孩子患ADHD的可能性之间存在轻微但重要的联系。对包括340万参与者的四项群组研究进行的第二次meta分析也发现,母亲甲状腺功能减退与后代患ADHD的可能性之间存在轻微但重要的的联系,这其中,没有尝试评估其他杂项因素的作用(Ge等人,2020)。
在丹麦,一项使用国家登记册的对超过一百万婴儿参与的全国群组研究进行了检查,比较了有一次流产经历的母亲的后代和有一次以上流产的母亲以及没有流产史的母亲的后代。研究发现,在对各种可能的混杂因素进行调整(结果影响不大)后,有一次流产的母亲的孩子患ADHD的可能性比没有流产的母亲的孩子高9%。有两次或更多次流产的母亲的孩子被诊断出患有ADHD的可能性增加22%。这种向上的暴露与健康反应趋势具有统计学意义(Wang等人,2020)。

(4)睡眠缺乏,压力,感染,贫困和创伤
台湾全民健康保险研究数据库进行的全台湾纵向群组研究,将14,000多名肠道病毒患者(ER71)与年龄和性别匹配了相同数量的对照组进行了比较。在进一步调整了父亲的职业和居住城市化水平后,发现肠病毒患者随后被诊断出患有ADHD的可能性增加了25%(Tseng等人,2020)。
在丹麦,一项针对怀孕期间失去近亲的妇女中的29,000多名儿童与同一群组中的其他100万名儿童的全国人口群组的研究,发现这些妇女所生的男孩患ADHD的可能性是其它常人的两倍(Li等人,2010)。
在美国,一项14,000多人参与的针对青少年健康的国家纵向研究的发现,在控制了对虐待儿童的人口,社会经济和家庭风险因素等变量后,ADHD的注意力不足的类型与遭受和性虐待和身体上的忽视有关。(欧阳等人,2008)。
一项基于人口的群组研究在韩国国民健康保险数据库中对18,000多名儿童进行了研究,结果发现较低的家庭收入与ADHD的患病率相关(Choi等人,2017)。瑞典一项超过800,000人的研究报告,即使在调整了家庭中共同的家族/遗传风险因素后,也得出了相似的结果(Larsson等人,2014b)。
在丹麦,一项100万人参与的国家登记纵向群组研究发现,罗特(Rutter)的逆境指标可以预测ADHD。家庭外护理具有很强的预测性。低社会阶层,父亲犯罪,产妇具有精神障碍和严重的婚姻不和谐都具有中等的预测能力。家里人多对ADHD的发生率没有影响(Ostergaard等人,2016)。
在丹麦,一项63万多名青年参与的使用家登记簿的研究发现,父母的受教育程度较低,失业率高,以及相对贫困与后代ADHD的风险之间存在正相关。社会不利因素的组合具有累积性的风险。例如,父母的相对少的收入加上仅接受过义务教育再加上失业,使后代患ADHD的风险大约增加了5%(Keilow等人,2020)。
在瑞典,根据对540,000多人参与的国家登记群组的研究发现,家庭累积逆境指标与ADHD的发病率之间存在正相关关系。家庭中出现人员死亡使随后家庭成员中ADHD的发病率增加了60%。大量的滥用毒品、犯罪或患有精神病的父母的孩子患有ADHD的可能性比出身于家里经济状况不好如住房不稳定和需要经济援助的孩子患ADHD的可能性高出一倍以上(Bjorkenstam等人,2018)。
2016年,美国全国儿童健康调查针对4,122名患有ADHD的美国青少年进行的抽样研究显示,家庭凝聚力的增强和社区支持降低了中度到重度ADHD的风险(Duh-Leong等人,2020)。
对于大多数ADHD患者来说,许多遗传和环境风险因素累积起来导致这种疾病。
ADHD的环境风险在生命的早期、胎儿时期或出生后早期发挥作用。
在极少数情况下,类似ADHD的症状可能是由生命早期的极端剥夺、单一的基因异常或生命早期的创伤性脑损伤引起的。这些发现有助于了解ADHD的病因,但对诊断ADHD没有帮助。
环境因素与ADHD发病之间的关联已经得到了非常高水平的证据支持。尽管有强有力的证据证明其因果关系,但对大多数ADHD来说,ADHD仍有可能是由于相关的遗传和环境影响。
总而言之,ADHD是一种具有高遗传力的家族性疾病,环境因素也可能发挥作用,要么在一些病例中作为主要因果因素,要么通过与遗传风险的相互作用。






 多动症
多动症